Ageing limits stemness and tumorigenesis by reprogramming iron homeostasis (2024)
https://doi.org/10.1038/s41586-024-08285-0
노화는 줄기세포의 수와 기능을 감소시키며, 이는 암 발생을 억제하는 중요한 역할을 한다. 이번 연구는 노화가 철분 대사를 재조정하여 줄기세포 능력(stemness)을 저하시킴으로써 암 발생과 진행을 억제하는 메커니즘을 밝혀냈다. 나이가 들면서 NUPR1 전사 인자와 리포칼린-2(lipocalin-2) 단백질의 발현이 증가하며, 이는 세포 내 철분 부족 상태를 유발한다. 이러한 변화는 암 예방에 긍정적인 역할을 하지만, 동시에 재생 의학과 같은 영역에서는 부정적인 영향을 미칠 수 있다.
연구 배경
1. 줄기세포와 노화
- 줄기세포는 조직 재생과 복구에 핵심적인 역할을 한다.
- 나이가 들수록 줄기세포의 수와 기능이 감소하며, 이는 암 발생 가능성을 억제하는 요인으로 작용한다.
- 폐의 2형 폐포 세포(AT2)는 폐 조직 재생에 중요한 줄기세포 역할을 하지만, 나이가 들수록 이 세포들의 자기 재생(self-renewal) 및 분화(differentiation) 능력이 크게 감소한다.
2. 철분 대사와 세포 생존
- 철분은 세포 성장, 분화, 에너지 생성에 필수적인 원소다.
- 젊은 세포에서는 철분이 충분히 공급되어 성장이 원활하지만, 노화된 세포에서는 철분 대사가 교란되며 기능이 저하된다.
- 철분 부족 상태는 줄기세포 능력을 저하시켜 세포의 재생과 조직 복구를 방해한다.
3. 암과 노화의 관계
- 대부분의 암은 젊은 나이에 시작되지만, 나이가 들수록 줄기세포 능력이 감소하면서 암 발생률이 낮아지는 현상이 관찰된다.
- 이는 노화가 암 발생을 억제하는 자연적인 방어 기제로 작용할 수 있음을 시사한다.
연구 방법
1. 마우스 모델 실험
- 젊은 마우스(12~16주)와 노화된 마우스(104~130주)를 대상으로 폐암 발생률과 종양 성장 속도를 비교했다.
- 크리스퍼(CRISPR) 기술을 활용해 폐암 유전자 변이를 유도하고, 나이에 따른 종양 발생 차이를 조사했다.
- 마우스의 폐포 세포(AT2 세포)를 분리하여 재생 능력 및 분화 능력을 평가했다.
2. 유전자 및 단백질 분석
- AT2 세포에서 NUPR1과 리포칼린-2의 발현 수준을 측정했다.
- DNA 메틸화와 같은 유전적 변화를 조사하여 노화와 관련된 발현 조절 메커니즘을 분석했다.
3. 철분 대사 실험
- 트랜스페린-결합 철분을 보충하거나, 철분을 제거하여 세포의 반응을 평가했다.
- 철분 대사가 세포의 성장과 암 발생에 미치는 영향을 측정했다.
연구 결과
1. 노화와 줄기세포 능력
- 나이가 들수록 AT2 세포의 자기 재생 능력이 50~70% 감소했다.
- 노화된 세포의 분화 능력 또한 감소하며, 이는 조직 재생에 부정적인 영향을 미쳤다.
2. NUPR1과 리포칼린-2의 역할
- NUPR1 전사 인자가 노화된 세포에서 활성화되며, 이는 리포칼린-2 발현 증가를 유도했다.
- 리포칼린-2는 철분을 세포 내에서 격리하여 ‘기능적 철분 부족 상태’를 유발했고, 이는 세포의 줄기세포 능력을 억제했다.
- 철분 보충 또는 NUPR1 억제는 노화된 세포의 자기 재생과 분화 능력을 부분적으로 회복시켰다.
3. 철분 대사의 나이 차이
- 젊은 세포는 충분한 철분 수준을 유지해 성장이 활발했다.
- 반면, 노화된 세포는 철분 부족으로 인해 성장이 제한되었고, 이는 줄기세포 능력 저하로 이어졌다.
- 철분 보충(예: 트랜스페린 투여)은 노화된 세포의 기능 회복에 긍정적인 영향을 미쳤다.
4. DNA 메틸화 변화
- 노화된 세포에서는 DNA 메틸화가 감소했고, 이는 NUPR1과 리포칼린-2의 발현 증가로 이어졌다.
- 젊은 세포에서 DNA 메틸화를 억제한 결과, 노화된 세포와 유사한 유전자 발현 패턴이 나타났다.

노화와 철분 대사 조절의 관계: NUPR1과 리포칼린-2의 역할
-
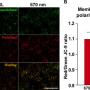
리포칼린-2의 발현 증가
- 노화된 AT2 세포와 폐암 세포에서 리포칼린-2 단백질 발현이 증가한 것이 관찰되었다.
- 이는 NUPR1 전사 인자가 활성화되면서 리포칼린-2 발현을 촉진하기 때문이다.
-
리포칼린-2와 철분 부족
- 리포칼린-2는 철분을 세포 내에서 격리시켜 '기능적 철분 부족' 상태를 만든다.
- 이러한 철분 부족은 노화된 세포의 자기 재생 능력과 암 발생 능력을 억제한다.
-
NUPR1 억제 실험
- NUPR1을 억제했을 때, 리포칼린-2의 발현이 감소했고, 이는 철분 부족 상태를 완화했다.
- 이 결과, 노화된 AT2 세포의 줄기세포 능력과 암 발생 가능성이 부분적으로 회복되었다.
-
철분 보충 실험
- 철분을 보충(예: 트랜스페린-결합 철분 투여)했을 때, 노화된 세포의 줄기세포 능력과 암 발생 능력이 크게 향상되었다.
- 이는 철분 부족이 노화된 세포의 주요 제약 요인임을 보여준다.
-
젊은 세포와 노화된 세포의 차이
- 젊은 AT2 세포는 충분한 철분을 유지해 암 발생이 촉진될 가능성이 있지만,
- 노화된 세포는 철분 부족 상태로 인해 암 발생 능력이 억제된다.
- 반면, 젊은 세포에서 NUPR1 억제는 철분 과잉을 유발해 세포 성장이 억제될 수 있다.
- 젊은 AT2 세포는 충분한 철분을 유지해 암 발생이 촉진될 가능성이 있지만,
-
의의
-
노화된 세포에서 NUPR1-리포칼린-2 축이 철분 대사를 재조정하여 세포의 줄기세포 능력을 억제하고 암 발생 가능성을 낮춘다는 것을 명확히 보여준다. 이 과정은 암 예방과 재생 의학 모두에서 중요한 통찰을 제공하며, 나이에 따른 맞춤형 철분 대사 조절의 필요성을 강조한다.
-
결론 및 시사점
1. 노화와 암 예방
- 노화로 인한 줄기세포 능력 저하는 암 발생을 억제하는 자연적인 방어 기전으로 작용할 수 있다.
- 하지만 이는 조직 재생과 같은 다른 생리적 기능에 부정적인 영향을 미칠 수 있어, 철저한 관리가 필요하다.
2. 철분 대사 관리의 중요성
- 철분 수준을 정기적으로 점검하고, 필요할 경우 적절히 보충하는 것이 중요하다.
- 노화된 사람에게 철분 보충은 재생 능력을 회복시키는 데 도움이 될 수 있다.
3. 맞춤형 치료 접근
- 젊은 세포와 노화된 세포의 철분 대사 차이를 고려한 개인 맞춤형 치료가 필요하다.
- 예를 들어, 젊은 환자는 철분 과잉을 피하고, 노화된 환자는 철분 보충에 중점을 두는 접근이 적합하다.
4. 암 예방 전략 강화
- 대부분의 암이 젊은 나이에 시작되므로 암 예방은 젊은 연령층에 집중해야 한다.
- 나이에 따른 암 발생 메커니즘을 이해하면 예방과 치료 모두에 새로운 기회를 제공할 수 있다.
나이가 들면서 세포는 철분을 격리하는 메커니즘을 통해 줄기세포 능력을 억제하고 암 발생 가능성을 낮춘다. 철분 보충이나 NUPR1 억제는 노화된 세포의 기능 회복에 긍정적 영향을 미칠 수 있으며, 이는 암 예방과 재생 의학에서 철분 조절의 중요성을 강조한다.

 편도 제거 수술, 스트레스 장애 위험 높인다? 연구 결과 분석
편도 제거 수술, 스트레스 장애 위험 높인다? 연구 결과 분석
 치매 환자의 13%, 간경변이 원인일 수 있다
치매 환자의 13%, 간경변이 원인일 수 있다