Transcriptome analysis of desmoplastic small round cell tumors identifies actionable therapeutic targets: a report from the Children’s Oncology Group (2020)
https://doi.org/10.1038/s41598-020-69015-w
복막성 소원형세포종(Desmoplastic Small Round Cell Tumor, DSRCT)은 주로 청소년기~젊은 남성에게 발생하는 매우 치명적인 연부조직암이다. 대부분 복강 내에서 다발성 종양으로 나타나며, 항암치료·수술·방사선치료를 병행해도 5년 무병생존율이 20% 미만으로 극히 낮다.
이 연구는 이 암의 분자적 발병기전을 정밀하게 규명하고, 치료 타깃으로 활용할 수 있는 유전자를 찾기 위해 수행됐다. 연구진은 어린이종양학그룹(Children’s Oncology Group, COG)이 보관한 DSRCT 조직 14개를 분석했으며, 그중 12개에서 진단적 특징인 EWSR1-WT1 융합 유전자가 존재함을 확인했다. 이 12개 시료를 중심으로 RNA 시퀀싱(RNA-seq), WT1 ChIP-seq, 그리고 단백질 수준의 면역염색을 수행해, DSRCT의 유전자 조절 네트워크를 재구성했다.
연구 방법
1) RNA 시퀀싱(RNA-seq)
-
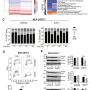
14개 환자 시료 중 EWSR1-WT1 양성인 12개를 분석 대상으로 선정했다.
-
Illumina HiSeq 2000 시스템으로 전사체를 시퀀싱하고, 발현 유전자 수천 개의 데이터를 TPM 기준으로 정량화했다.
-
발현 변동이 큰 상위 5,000개 유전자를 이용해 단일샘플 기반 유전자세트 풍부도 분석(ssGSEA)을 수행했다.
-
이를 통해 DSRCT 내부에서도 DNA 손상반응 경로와 근육발달 관련 경로가 크게 달라지는 두 하위 그룹이 존재함을 확인했다.
2) WT1 ChIP-seq
-
EWSR1-WT1 융합단백질이 실제로 어떤 유전자의 조절영역에 결합하는지 규명하기 위해, JN-DSRCT-1 세포주를 이용해 WT1 항체로 ChIP-seq을 수행했다.
-
분석 결과 2036개의 유의한 결합 피크가 발견됐고, 그중 1284개가 단백질 코딩 유전자와 연관되어 있었다.
-
특히 IGF2, FGFR4, ROCK1, PEX5, CTCFL 등의 유전자가 직접 결합 표적으로 확인됐다.
-
피크 분포는 대부분 intergenic(유전자 사이) 또는 intronic(인트론) 영역에 집중돼 있었는데, 이는 다른 융합육종(예: 유잉육종, 윌름스종 등)에서 관찰되는 enhancer 기반 발암기전과 유사한 양상이었다.
3) 단백질 수준 검증 (Western blot, 면역조직염색)
-
RNA 수준에서 확인된 주요 유전자를 단백질 수준에서도 확인했다.
-
특히 IGF2, FGFR4, CD200, CD276(B7-H3)에 대해 단백질 발현을 측정했고, 실제로 환자 종양조직에서도 강한 발현이 관찰됐다.
주요 발견
1) EWSR1-WT1 융합이 DSRCT의 발암 중심축이다
-
DSRCT의 가장 중요한 유전적 특징은 염색체 11번과 22번 사이의 전위(t(11;22)(p13;q12))로, 이로 인해 EWSR1과 WT1 유전자가 융합된 EWSR1-WT1 융합단백질이 형성된다.
-
이 융합단백질은 전사인자(transcription factor)로 작용하며, 정상 WT1의 DNA 결합 영역을 유지하면서 EWSR1의 전사활성 도메인과 결합해 비정상적인 유전자 발현을 촉진한다.
-
이 단백질은 여러 성장신호·세포생존 경로(Wnt, Notch, ECM 신호 등)에 관여하는 유전자들을 활성화시켜 강력한 종양성 증식 신호를 유도한다.
2) IGF2 - 가장 강력히 발현된 성장 인자
-
RNA-seq 데이터에서 IGF2는 전체 유전자 중 상위 0.5% 수준으로 매우 강하게 발현됐다.
-
WT1 ChIP-seq에서도 IGF2 유전자 위치에서 뚜렷한 결합 피크가 관찰되어, EWS-WT1이 IGF2를 직접 전사 조절함이 입증됐다.
-
IGF2는 세포의 증식과 생존을 유도하는 IGF-1R 신호 경로의 핵심 리간드로, DSRCT의 성장을 지속적으로 자극한다.
-
EWS-WT1 억제 후에도 IGF2 발현은 완전히 사라지지 않았다. 이는 H19-DMR(11p15.5 염색체 영역)의 후성유전적 교란 - 즉, IGF2와 H19 인쇄유전자(imprinted genes)의 조절 이상 - 이 IGF2 과발현에 기여함을 의미한다.
-
이러한 인쇄유전자 교란은 유전적 ‘브레이크’가 풀린 상태를 의미하며, DSRCT의 지속적 성장에 결정적 역할을 하는 것으로 보인다.
3) FGFR4 - EWS-WT1의 또 다른 직접 표적
-
FGFR4 유전자 역시 EWS-WT1의 결합 부위가 확인됐고, EWS-WT1을 억제하면 FGFR4 단백질 수준이 유의하게 감소했다.
-
FGFR4는 세포 성장·분화·생존에 관여하는 수용체형 티로신키나아제로, 여러 고형암(특히 횡문근육종 등)에서 발암 촉진자로 알려져 있다.
-
환자 간 FGFR4 발현 정도는 크게 달랐지만, 일부 DSRCT 환자에서는 매우 높은 수준으로 관찰됐다.
-
이는 향후 FGFR4 억제제가 고발현 환자군의 맞춤형 치료제로 활용될 가능성을 제시한다.
-
실제로 pan-FGFR 억제제 및 FGFR4 특이적 억제제가 여러 임상시험에서 진행 중이며, DSRCT에도 적용할 수 있는 근거가 된다.
4) CD200과 CD276(B7-H3) - 새로운 면역치료 표적
-
종양의 면역회피 기전을 분석한 결과, PD-1/PD-L1 경로는 거의 발현되지 않았지만 CD200과 B7-H3가 강하게 발현됐다.
-
이 두 단백질은 모두 EWS-WT1 융합과 독립적으로 발현되어, 융합음성 DSRCT에서도 적용 가능한 면역치료 타깃이다.
-
B7-H3(CD276)는 T세포의 공격을 억제하는 면역억제 단백질로, 여러 암에서 예후 불량과 연관되어 있다.
-
항-B7-H3 항체(예: enoblituzumab)는 현재 다른 암종에서 임상시험 중이다.
-
DSRCT에서도 B7-H3가 CAR-T 세포 치료용 항원 후보로 활용될 수 있다.
-
-
CD200은 면역세포(특히 대식세포와 수지상세포)의 활성화를 억제하는 면역억제 단백질로,
-
항-CD200 단일항체(samalizumab)가 혈액암 임상시험에서 평가 중이다.
-
본 연구에서는 DSRCT 세포에서도 CD200의 강한 발현이 확인돼, 향후 면역억제 회로 차단 전략으로 주목된다.
-
임상적 의의
1) 기존 치료의 한계 극복 가능성
-
DSRCT는 전통적인 항암화학요법에 거의 반응하지 않으며, 수술과 방사선치료를 병행해도 재발률이 높다.
-
이번 연구는 분자적 근거에 기반한 ‘표적치료 조합’의 가능성을 제시했다.
2) 새로운 치료 방향 제안
-
연구진은 IGF2와 FGFR4 같은 성장신호 억제제에 더해, CD200/B7-H3 면역관문억제제를 병합하는 다중표적 치료 전략이 DSRCT 치료의 새로운 길이 될 수 있다고 제안했다.
3) DSRCT의 독립적 분자 아형 확인
-
주성분분석(PCA) 결과, DSRCT는 다른 융합양성 육종(유잉육종, 횡문근육종, 활막육종 등)과 전사체 수준에서 완전히 독립된 군집으로 나타났다.
-
이는 단순히 유사한 형태학적 암이 아니라, 분자적으로 구별되는 독립 암종임을 보여준다.

EWS-WT1 단백질의 유전자 결합 지도
-
WT1 항체를 이용한 ChIP-seq 분석에서 약 2000개의 유의한 결합 피크가 검출됐다.
-
이 피크 중 60% 이상이 유전자 외부 조절영역(intergenic, intronic)에 존재했다.
-
EWS-WT1이 결합한 대표 유전자는 IGF2, FGFR4, ROCK1, PEX5, CTCFL, TSPAN7 등으로, 세포 성장과 신호전달, 세포골격 조절 경로에 관여한다.
-
이는 DSRCT의 발암 경로가 조절 인핸서(enhancer) 수준에서의 유전자 활성화에 의해 구동된다는 사실을 보여준다.
연구 결론
이 연구는 DSRCT의 발암 중심축이 되는 EWSR1-WT1 융합 단백질의 직접 표적 유전자와 후성유전적 조절 기전을 밝혀냈다.
핵심 결론은 다음과 같다.
-
IGF2: DSRCT에서 가장 강하게 발현되는 성장 인자이며, 후성유전적 교란이 발현을 유지시킨다.
-
FGFR4: EWS-WT1의 직접 표적이자, 일부 환자에서 고발현되는 치료 가능 타깃이다.
-
CD200 / CD276(B7-H3): 융합유전자와 무관하게 종양세포에서 발현되는 면역억제 인자로, 차세대 면역치료 타깃이 될 수 있다.
결국 DSRCT는 단일 치료 접근으로는 극복이 어렵고, IGF2/FGFR4 성장신호 억제 + 면역관문 차단 치료의 병합 전략이 향후 생존율 향상에 실질적 돌파구가 될 것으로 보인다.

 재발성 DSRCT, DNA 복구 강화와 면역 회피로 되살아난다
재발성 DSRCT, DNA 복구 강화와 면역 회피로 되살아난다