Rapid amyloid-β clearance and cognitive recovery through multivalent modulation of blood–brain barrier transport (2025)
https://doi.org/10.1038/s41392-025-02426-1
연구 배경: 알츠하이머의 숨은 원인 - 고장 난 '뇌의 문지기'
알츠하이머병은 뇌에 베타아밀로이드(amyloid-β, Aβ) 가 축적되면서 신경세포가 손상되고 인지 기능이 점차 떨어지는 병이다. 그동안 대부분의 치료는 Aβ 자체를 줄이거나 분해하는 데 집중했지만, 실제로는 Aβ를 계속 만들어내는 것이 아니라 '뇌 밖으로 내보내지 못해서 쌓이는 것' 이 핵심 문제라는 점이 점점 분명해지고 있다.
그 배경에는 혈뇌장벽(Blood–Brain Barrier, BBB) 이 있다. BBB는 뇌혈관을 구성하는 미세한 내피세포들이 만든 방어막으로, 영양분은 들여보내고 독성 물질과 노폐물은 내보내는 매우 정교한 생리적 필터다.
정상 상태에서는 LRP1(Low-density lipoprotein receptor-related protein 1) 이라는 수용체가 BBB의 내피세포에 자리 잡고, 뇌 안의 Aβ를 포착해 혈액으로 내보내는 역할을 한다. 그러나 나이가 들거나 알츠하이머가 진행되면 LRP1의 양이 줄고, 위치도 내피세포에서 떨어져 혈관 주위세포(pericyte) 쪽으로 옮겨가며, 결과적으로 Aβ가 뇌 안에 갇히는 현상이 일어난다.
연구 설계
-
연구 목적
-
혈뇌장벽의 LRP1 수용체 경로를 복원하여 뇌 속 Aβ 제거와 인지 기능 회복 유도
-
LRP1-Aβ 결합의 세기를 조절해 정상적인 '청소 경로(PACSIN2-mediated transcytosis)'를 다시 활성화시키는 나노입자 개발
-
-
핵심 개념
-
LRP1은 결합 친화도(결합 세기)에 따라 서로 다른 경로로 이동함
-
높은 친화도(high avidity): Rab5 의존성 리소좀 분해 경로 → 수용체 소실
-
중간 친화도(mid avidity): PACSIN2 의존성 비분해 경로 → Aβ 제거 지속
-
-
알츠하이머에서는 Aβ의 지나친 결합력으로 LRP1이 계속 분해되어 청소 기능이 사라짐
-
따라서 '중간 친화도'로 맞춘 리간드를 활용해 LRP1이 정상 경로로 이동하도록 재조정하는 것이 핵심
-
-
치료제 설계
-
Angiopep-2 펩타이드를 LRP1 표적 리간드로 사용
-
고분자 조성: P[(OEG)10MA]20-PDPA120
-
리간드 개수별 비교군
-
A0-POs: 리간드 없음
-
A1: Angiopep-2 단독
-
A40-POs: 리간드 40개 → 중간 친화도 설계
-
A200-POs: 리간드 200개 → 높은 친화도, 수용체 분해 유도
-
-
-
모델 및 투여 방식
-
APP/PS1 알츠하이머 모델 생쥐 (3개월~12개월 연령)
-
정맥주사 방식으로 단회 투여
-
2시간, 12시간, 6개월 시점별로 평가
-
실험 방법 요약
-
주요 관찰 지표
-
Aβ, LRP1, PACSIN2, Rab5 농도 (ELISA)
-
뇌 및 혈중 Aβ 변화 (ELISA, PET-CT)
-
BBB 내 단백질 위치 (면역형광, STED 초해상 현미경)
-
전뇌 3D 투명화 영상 (CUBIC-L 처리)
-
인지 기능 평가 (Morris water maze, 둥지 짓기, 설탕 선호도 실험)
-
-
데이터 분석
-
LRP1–CD31, LRP1–CD146 공위치 분석 (Pearson 상관계수)
-
뇌 영역별 Aβ 부피 계산 (Allen Brain Atlas 14개 구역)
-
행동 데이터는 ANOVA 및 t-검정으로 통계 분석
-
주요 결과
1) LRP1 위치 변화와 BBB 손상 양상
-
정상 생쥐: LRP1이 내피세포(CD31)와 강하게 공위치함 → 정상 Aβ 배출 유지
-
알츠하이머 생쥐
-
3개월: 내피세포에 LRP1 존재, Aβ와 높은 공위치
-
12개월: LRP1이 pericyte(CD146) 주변으로 이동, Aβ와의 공위치 감소
-
LRP1-Aβ-CD31 공위치도(PCC) 지속적 감소, LRP1-Aβ-CD146 공위치도는 증가
-
이는 내피세포 기반의 Aβ 제거 기능이 약화되고 pericyte 의존 경로로 바뀜을 의미
-
2) 연령별 단백질 정량 분석
-
Aβ: 나이에 따라 뇌 전체 농도 급증, 특히 6~12개월에서 급격히 상승
-
LRP1: 연령 증가에 따라 지속적 감소
-
PACSIN2: LRP1 감소와 함께 동반 하락
-
Rab5: 리소좀 분해 경로 활성화로 상승
-
위 결과는 LRP1 분해 중심의 비정상 수송 경로가 점점 강화된다는 것을 의미
3) A40-POs 투여 후 Aβ 제거 효과
-
투여 2시간 후
-
뇌 속 Aβ 8603.6 → 4236.3 ng/ml (-45%)
-
혈중 Aβ 85.3 → 673.5 ng/ml (×8 증가)
-
뇌에서 제거된 양과 혈액으로 나온 양이 거의 일치 → 실제 배출 확인
-
-
PET-CT 영상: [18F]AV-45 신호 46.25% 감소
-
전뇌 3D 영상: 14개 구역 모두에서 Aβ 부피 평균 41% 감소
-
면역염색 결과: BBB 주변의 Aβ 신호 소실, 혈관 내강으로 이동한 Aβ 관찰
4) BBB 구조 및 수용체 복구
-
LRP1–CD31 공위치율 78% 회복 → 내피세포 기능 정상화
-
PACSIN2 단백질 재위치 및 발현 증가
-
Rab5 발현 감소 → 리소좀 경로 억제
-
STED 현미경: LRP1이 혈관벽에서 군집화되어 활발한 transcytosis 수행
5) 인지 및 행동 평가
-
Morris water maze (공간 기억력 실험)
-
A40-POs 투여군: 학습 속도 향상, 탐색 거리와 도착 시간 단축
-
Sham군(치료 없음)보다 현저히 우수, 정상 생쥐와 유사한 수준
-
6개월 후에도 성능 유지 → 장기적 인지 회복 확인
-
-
둥지 짓기 테스트
-
A40-POs군: 종이 조각을 더 잘 찢고 구조적으로 완성된 둥지 형성
-
세밀 운동 능력 및 계획 행동 회복 지표
-
-
설탕 선호도 테스트
-
A40-POs군: 단맛 선호 비율 증가 → 보상 감정 및 정서 기능 회복
-
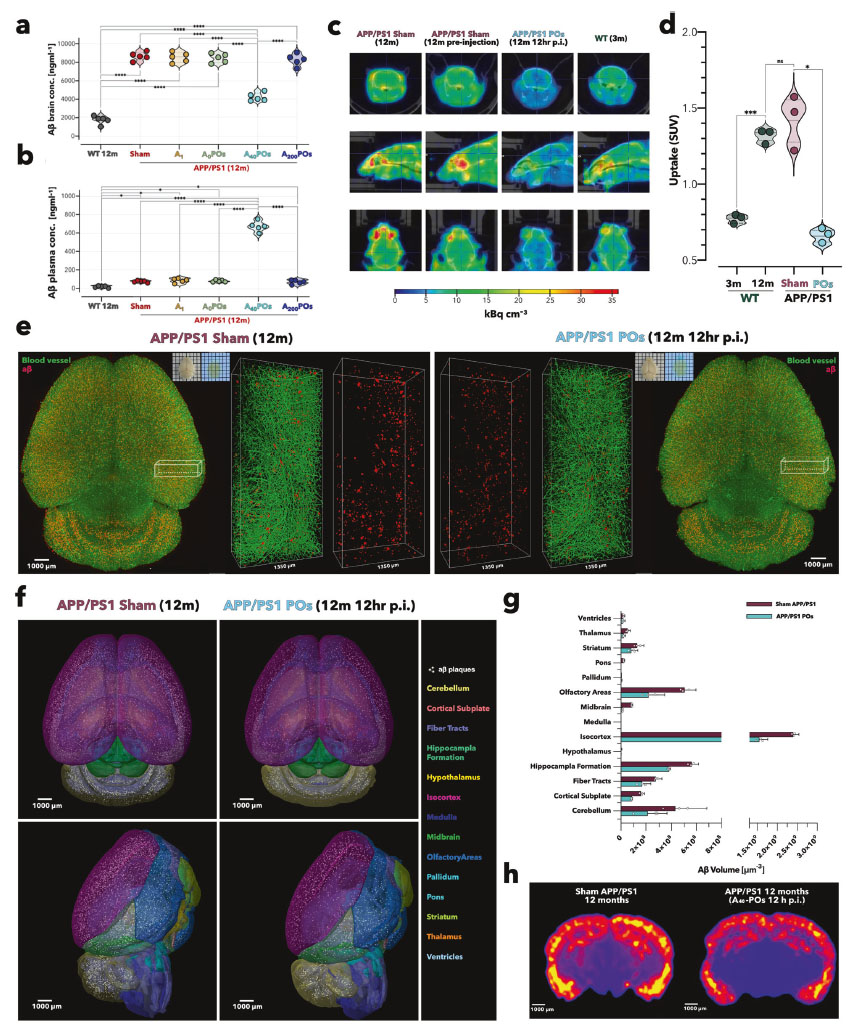
A40-POs 투여 후 아밀로이드 제거 효과
(a, b) ELISA 그래프 ― 아밀로이드 농도 변화
-
Aβ를 뇌와 혈액에서 각각 정량 분석한 결과다.
-
뇌(A): A40-POs 투여 후 2시간 만에 Aβ가 약 45~50% 감소했다.
-
8603 → 4236 ng/ml 수준으로 절반 가까이 줄었음
-
-
혈액(B): 같은 시간 동안 Aβ 농도가 약 8배 증가했다.
-
85 → 673 ng/ml로 상승
-
-
이 수치는 단순한 변동이 아니라, 뇌 안의 Aβ가 실제로 혈류로 빠져나왔다는 물리적 증거다.
-
다른 대조군(A1, A0-POs, A200-POs)은 거의 변화가 없었으며, A40-POs의 '중간 친화도 설계'가 핵심적으로 작용했음을 보여준다.
(c, d) PET-CT 영상 ― 뇌 전체에서 신호 감소 확인
-
[18F]AV-45라는 방사성 추적자를 이용해 뇌 속 Aβ를 영상으로 찍은 장면이다.
-
투여 전에는 APP/PS1 생쥐의 뇌 전체가 붉은색·노란색 신호로 강하게 빛나며 Aβ 축적이 많았다.
-
A40-POs 투여 12시간 후, 신호가 절반 이상 줄어들며(~46%) 뇌 전체에서 아밀로이드가 광범위하게 사라진 모습이 나타났다.
-
해당 이미지는 "나노입자가 실제로 뇌 장벽을 통과해 단백질 찌꺼기를 치운다"는 시각적 증거다.
(e–h) 3D 투명화 및 뇌 지도 ― 아밀로이드 제거 범위 시각화
-
뇌 조직을 투명화(CUBIC-L 방식)한 뒤, Aβ(빨간색)와 혈관(초록색)을 3D로 촬영한 영상이다.
-
(e): 치료받은 생쥐의 뇌에서는 붉은 점(아밀로이드 축적 부위)이 현저히 줄어들었다.
-
(f): 뇌를 Allen Brain Atlas에 따라 14개 영역으로 나누어 분석했을 때 거의 모든 영역에서 Aβ 감소가 나타남
-
(g): 전체 Aβ 부피가 평균 41% 감소
-
(h): 열지도(heat map)로 보면, 이전에는 진하게 붉었던 뇌 중심부가 옅은 노란색으로 바뀌며 아밀로이드 축적이 사라졌음을 직관적으로 보여준다.
핵심 해석
-
이 그림은 단순히 "아밀로이드가 줄었다"는 데이터가 아니라 뇌에서 혈액으로의 실제 이동(배출 경로 활성화) 을 입증했다는 점이 중요하다.
-
투여 후 불과 2시간 만에 뇌 속 단백질 찌꺼기를 절반 가까이 청소했고 12시간 이내에 뇌 전체에서 시각적으로 제거가 확인되었다.
-
특히 PET-CT와 3D 영상의 일치된 결과는 A40-POs가 혈뇌장벽을 통과해 '청소 시스템(LRP1–PACSIN2 경로)'을 되살렸다는 근거이다.
연구 결론
이 연구는 알츠하이머 치료 패러다임을 "뇌 안으로 약을 넣는 방식"에서 벗어나 "뇌의 장벽을 고쳐 스스로 청소하게 만드는 방식"으로 제안했다.
A40-POs는 단순한 약물 전달체가 아니라, 혈뇌장벽 내피세포의 수용체 이동 경로를 재프로그래밍하는 치료제였다.
이를 통해 다음 세 가지가 동시에 이루어졌다.
-
뇌 속 베타아밀로이드의 급속한 제거 (2시간 내 45% 감소)
-
손상된 혈뇌장벽의 구조적·기능적 복원 (LRP1-PACSIN2 경로 회복)
-
인지 능력의 장기적 회복 (6개월 유지)
이 접근은 단백질 축적 자체보다 혈관-신경 상호작용의 실패를 질병의 뿌리로 보는 새로운 관점을 제시하며, 알츠하이머뿐 아니라 파킨슨병, 루게릭병 등 BBB 기능 이상이 동반된 다른 신경퇴행성 질환에도 확장 가능성을 보여준다.


 IL-6와 뇌 건강: 염증이 인지 능력에 미치는 부정적 효과
IL-6와 뇌 건강: 염증이 인지 능력에 미치는 부정적 효과



 손님
손님