Genomic Breakpoint Characterization and Transcriptome Analysis of Metastatic, Recurrent Desmoplastic Small Round Cell Tumor (2023)
https://doi.org/10.1155/2023/6686702
Desmoplastic Small Round Cell Tumor(DSRCT)는 복강 내에 주로 발생하는 소아 및 청소년 연부조직암으로, 22번 염색체의 EWSR1과 11번 염색체의 WT1 유전자가 전좌되어 형성된 EWSR1-WT1 융합 유전자가 주요 발암 원인이다. 처음 항암치료에는 반응하지만 80% 이상이 재발하며, 5년 생존율은 15~25%로 매우 낮다. DSRCT는 발생 빈도가 극도로 낮아, 재발 메커니즘과 분자적 특징을 연구할 충분한 표본이 존재하지 않았다. 해당 연구는 동일 환자에서 5년 간격으로 얻은 원발 DSRCT와 재발(간 전이) DSRCT를 비교하여 유전적 절단점(genomic breakpoint)과 전사체 변화를 분석하였다.
연구 목적 및 접근
-
EWSR1-WT1 융합의 형성 메커니즘 규명
-
동일 환자 원발·재발 종양 간 전사체(RNA) 비교 분석
-
재발 시 활성화되는 분자 경로 탐색
-
향후 치료 표적 후보 도출
분석 대상
-
환자: 동일인에서 5년 간격으로 채취된 원발(복막) 및 재발(간 전이) DSRCT
-
세포주: JN-DSRCT-1, BER-DSRCT, BOD-DSRCT, SK-DSRCT1, SK-DSRCT2
-
추가 종양 샘플: 5개 독립 DSRCT 조직
-
총 11개 샘플의 EWSR1-WT1 융합 절단점 지도 작성
유전적 절단점 분석
1) 절단점 다양성
-
모든 DSRCT 샘플은 고유한 EWSR1-WT1 절단점을 가짐
-
공통 hotspot은 존재하지 않음
-
개별적 DNA 손상-복구 사건에 의해 융합 발생
2) 미세상동성(microhomology)
-
11개 중 8개 샘플에서 1~3 bp의 microhomology 발견
-
이는 MMEJ(Microhomology-Mediated End Joining) 복구 경로의 관여를 시사
-
비상동말단접합(NHEJ)의 흔적(삽입 염기 등)은 없음
3) 비교 분석
-
microhomology 존재율
-
DSRCT: 약 75%
-
Ewing 육종: 46%
-
ALCL: 38%
-
급성 림프구성 백혈병: 24%
-
-
DSRCT에서 유독 MMEJ 특성이 강하게 나타남
4) 생물학적 시사점
-
NHEJ 효소(Ku70, Ku80, LIG4) 저활성 세포에서 MMEJ가 우세하게 작동
-
신경능선 유래 세포(neural crest-derived cell)에서 MMEJ 관련 효소(PARP1, LIG3) 고발현
-
DSRCT의 기원이 신경능선 줄기세포 계열일 가능성을 제시
전사체(RNA-seq) 분석 결과
1) 분석 개요
-
원발 DSRCT vs 재발 DSRCT 비교
-
발현 증가 유전자: 1,584개
-
발현 감소 유전자: 1,293개
2) 상향 조절된 경로 (Upregulated)
-
DNA 복구 관련 경로
-
상동재조합(homologous recombination)
-
염기절제복구(base excision repair)
-
이중가닥절단 복구(double-strand break repair)
-
불일치 복구(mismatch repair)
-
-
RNA 스플라이싱 및 가공
-
spliceosome 활성 증가
-
관련 유전자: NOVA1, ELAVL2, ESRP2, SRRM4
-
비정상 스플라이싱을 통한 단백질 다양성 증가
-
-
세포주기 조절
-
세포분열 및 DNA 복제 관련 유전자 과발현
-
종양 세포의 증식 속도 가속화
-
3) 하향 조절된 경로 (Downregulated)
-
면역 관련
-
TNF 신호전달 감소
-
T세포 증식·대식세포 활성화·사이토카인 분비 억제
-
선천면역·적응면역 모두 억제
-
-
세포 부착 및 ECM 구성
-
focal adhesion, 세포 간 접착 분자 발현 감소
-
전이 가능성 증가
-
-
대사 관련
-
스테로이드 및 지방산 합성 경로 억제
-
생존 중심 대사 재편
-
EWSR1-WT1 융합 유전자의 지속적 영향
1) 융합 단백질의 역할 유지
-
재발 종양에서도 EWSR1-WT1 융합에 의해 조절되는 유전자군이 여전히 우세
-
융합 단백질이 재발 시점에서도 주요 발암 드라이버로 유지됨
2) 구체적 유전자 변화
-
상향 조절 유전자: LCK, TRIM67, CCL25, CAMK2A
-
하향 조절 유전자: COL12A1, IGF1, TGFBR2, ADGRA2
-
EWSR1-WT1 자체 발현도 약간 상승(ΔΔCq = 0.3)
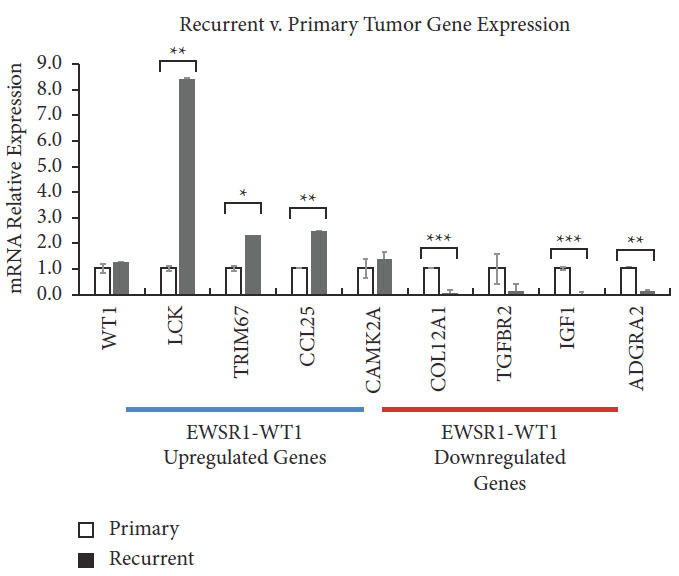
재발 DSRCT에서 DNA 복구 유전자는 활성화되고, 면역 반응 유전자는 억제됐다
1) 상향 조절된 경로 (Upregulated in recurrent DSRCT)
-
재발된 종양에서 다음 유전자군의 발현이 뚜렷하게 증가했다.
-
Homologous recombination (상동재조합)
→ 손상된 DNA를 복제 시점에 정확히 복원하는 경로.
→ 방사선·항암제 손상에 대한 저항성 강화를 의미함. -
DNA double-strand break repair (이중가닥 절단 복구)
→ 이중가닥 손상에 직접 관여하는 RAD51, BRCA1, CHK1 등의 경로 활성화. -
mRNA splicing (전사 후 가공 과정)
→ RNA 가공 효소들의 발현이 증가해 단백질 다양성이 증가.
→ 세포의 적응성과 생존력이 강화됨. -
Cell cycle control (세포주기 조절)
→ 세포분열 촉진 관련 유전자 과발현 → 종양 성장 속도 증가.
-
2) 하향 조절된 경로 (Downregulated in recurrent DSRCT)
-
반대로, 다음 유전자군은 재발 후 현저히 감소했다.
-
Immune response (면역 반응)
→ T세포 활성화, 사이토카인 분비, 대식세포 반응 관련 유전자 전반적 억제.
→ 종양이 면역 회피(immune evasion) 능력을 획득한 것으로 해석됨. -
Focal adhesion (초점 부착)
→ 세포-기질 간 접착 감소 → 이동성, 전이성 증가. -
ECM organization (세포외기질 재구성)
→ 조직 구조 유지 관련 단백질 감소 → 침윤성 강화.
-
3) 그래프 해석
DNA 손상 복구와 RNA 스플라이싱 관련 유전자가 활성화되면서 항암 내성과 세포 생존율이 증가하고, 반대로 면역계와 세포 부착 관련 유전자는 억제돼 종양이 면역 회피와 전이에 유리한 방향으로 진화했음을 나타낸다.
치료적 시사점
1) DNA 복구 억제 기반 치료
-
RAD51 억제제(B02, R1-1) → 상동재조합 억제
-
CHK1 억제제 → 항암 내성 억제 가능성
-
DSRCT 대상 CHK1 억제제 임상시험 진행 중
2) PARP 억제제의 가능성
-
PARP1은 MMEJ 핵심 효소
-
olaparib: DSRCT 세포주에서 IC50 약 1.3 μM 수준 효과
-
MMEJ 억제를 통한 종양 성장 억제 기대
3) 융합 단백질 표적 약물
-
Lurbinectedin, Trabectedin → EWSR1-WT1 전사활동 억제
-
임상 사례에서 완전 관해 및 안정 질환 유지 보고
-
재발 DSRCT에도 적용 가능성 높음
4) 면역치료 한계
-
DSRCT는 면역세포 침윤이 적은 immune-cold 종양
-
재발 후 면역 관련 유전자 추가 감소
-
면역관문억제제(ICIs) 효과 제한적
연구 결론
이 연구는 DSRCT에서 처음으로 원발과 재발 종양을 직접 비교한 분자 분석으로, 재발 메커니즘을 4가지 측면에서 규명했다.
① MMEJ 기반의 융합 유전자 형성
② DNA 복구 및 스플라이싱 경로 과활성화
③ 면역 및 세포 부착 기능 억제
④ 융합 단백질 의존성 지속
결국 DSRCT는 융합 단백질 중심의 발암 구조를 유지하며 DNA 복구 억제제 및 융합 표적 치료가 유망한 전략임을 보여줬다.


 Cyclin D1–CDK4/6–RB 경로가 DSRCT 치료 표적이 될 수 있다
Cyclin D1–CDK4/6–RB 경로가 DSRCT 치료 표적이 될 수 있다
 DSRCT에서 IGF2·FGFR4·CD200·CD276이 새로운 치료 표적으로 제안된다
DSRCT에서 IGF2·FGFR4·CD200·CD276이 새로운 치료 표적으로 제안된다




 손님
손님