Desmoplastic small round cell tumor is dependent on the EWS-WT1 transcription factor (2020)
https://doi.org/10.1038/s41389-020-0224-1
연구 배경
Desmoplastic Small Round Cell Tumor(DSRCT)는 주로 청소년 및 젊은 남성에게서 발생하는 매우 공격적인 연부조직 악성종양이다. 대부분 복강 내 여러 결절 형태로 발견되며, 진단 당시 이미 광범위한 전이를 동반한다. 현재까지 알려진 치료법은 항암화학요법, 수술, 방사선치료의 병용이지만 장기 생존율은 극히 낮다. 평균 생존기간은 약 17개월, 5년 생존율은 20% 미만이다.
이 종양의 핵심 분자적 특징은 염색체 전좌 t(11;22)(p13;q12)로, EWSR1 유전자의 전사활성 영역과 WT1 유전자의 DNA 결합 영역이 융합되어 EWS-WT1 융합 단백질을 만든다. 이 단백질은 종양 진단의 결정적 지표이며, 발암의 중심적인 역할을 하는 것으로 여겨진다. 그러나 실제로 DSRCT 세포가 EWS-WT1의 지속적 발현에 얼마나 의존하는지는 명확히 규명되지 않았다. 또한, EWS-WT1이 하위에서 조절하는 유전자 네트워크에 대한 포괄적 분석도 없었다.
이 연구는 이러한 공백을 메우기 위해 EWS-WT1만을 특이적으로 억제하는 방법을 개발하고, 이를 통해 DSRCT가 실제로 이 단백질에 생존을 의존하는지를 입증했다.
연구 방법 (개조식)
1) 세포주 및 배양 조건
-
사용 세포주: BER 및 JN-DSRCT-1 (모두 인간 DSRCT 유래)
-
EWS-WT1 전좌 확인: FISH 분석으로 확인
-
배양 조건
-
RPMI-1640 배지
-
10% FBS, 2 mM L-glutamine, 100 U/mL penicillin, 100 μg/mL streptomycin
-
37°C, 5% CO₂ 환경
-
2) EWS-WT1 선택적 억제 전략
-
문제점: EWSR1과 WT1의 정상 단백질이 함께 발현되므로 융합단백질만 선택적으로 억제하기 어려움
-
해결책: EWS-WT1 융합부위를 양쪽에서 동시에 표적하는 맞춤형 siRNA 2종 설계
-
siRNA 농도 조절
-
2 nmol/L에서 EWS-WT1만 억제
-
높은 농도에서는 정상 EWSR1·WT1 발현도 감소하므로 배제
-
-
확인 방법: Western blot으로 발현 확인
3) 세포 증식 및 생존 평가
-
세포 증식 측정: Incucyte Zoom 장비로 2시간 간격 실시간 모니터링
-
비교군
-
미처리군 (Media)
-
비표적 siRNA군 (siNeg)
-
양성 대조군 (siDeath)
-
-
통계 분석: t-test 및 다중 비교 보정 수행
4) 형태 변화 및 세포사멸 분석
-
EWS-WT1 억제 후 시간대별 세포 형태 관찰 (16~96시간)
-
Apoptosis 분석
-
Cleaved PARP 단백질 검출 (Western blot)
-
Caspase-3/7 활성화 측정 (형광 지표 사용)
-
-
세포사멸 시점: 억제 60~72시간 이후
-
특징: 성장 정지 후 2차적으로 세포사멸 발생
5) RNA 시퀀싱 및 차등 유전자 발현 분석
-
시점: EWS-WT1 억제 48시간 후 (2차적 사멸 영향 최소화 시점)
-
RNA 추출: Qiagen QiaCube 사용
-
라이브러리 제작: KAPA-stranded mRNAseq kit
-
분석 툴: STAR aligner, DESeq2, apeglm
-
통계 기준: q-value < 0.05, |log₂FC| > 2
-
반복: 각 세포주 3개 생물학적 반복 수행
6) 기능적 유전자 세트 분석(GSEA)
-
사용 툴: fgsea 패키지
-
분석 기준: Hallmark 및 KEGG 유전자 세트 기반
-
공통 상위 경로 식별
-
세포주기 조절, DNA 복구, MYC, E2F, TGFB, PRC2 등
-
7) 단백질 수준 검증
-
RNA-seq에서 관찰된 주요 유전자 중 일부를 Western blot으로 검증
-
ERG (유도형, 발현 증가)
-
CEBPD (억제형, 발현 감소)
-
-
항체
-
EWSR1 (Cell Signaling #11910)
-
WT1 (Santa Cruz sc-7385)
-
ERG (Abcam ab92513)
-
CEBPD (Abcam ab65081)
-
연구 결과
1) EWS-WT1 억제 → 세포 증식 정지
-
siRNA 처리 후 48시간 이내 EWS-WT1 단백질 소실
-
두 세포주 모두 세포 밀도 급격히 감소
-
미처리군과 siNeg군은 정상 증식 유지
→ EWS-WT1은 DSRCT 세포 증식에 필수적임이 입증됨
2) 형태 변화 및 세포사멸 유도
-
억제 24~48시간: 세포 커지고 납작해짐 (분화유사 형태)
-
억제 60~72시간: PARP 절단 및 caspase-3/7 활성화
→ 성장 정지 이후 2차적 apoptosis 진행
3) 전사체 변화
-
총 1,879개 유전자 발현 변화 (±2 log₂FC 이상)
-
억제된 유전자가 유도된 유전자보다 많음
-
두 세포주 공통 변화 유전자
-
68개 유도형(up-regulated)
-
223개 억제형(down-regulated)
-
-
주요 경로 변화
-
FGFR4, JAK3, IGF, Wnt, PDGFA, BAIAP3 등
-
-
단백질 수준에서도 ERG 증가, CEBPD 감소 확인
4) 기능적 경로 분석(GSEA)
-
MYC 활성 억제 → 세포 증식 저하
-
에스트로겐 신호 억제 → 남성 중심 발병과 부합
-
TP53 신호 억제 + DNA 복구 경로 활성화 → 항암제 저항성 기전 가능성
-
PRC2 복합체 조절 이상 → 후성유전적 발암 메커니즘 시사
-
E2F 및 TGFB, mTOR, IGF 신호 경로 이상 → 다른 육종과 공통점 확인
5) EWS-FLI1과의 유사성
-
유잉 육종의 EWS-FLI1과 EWS-WT1은 구조적으로 다르지만 공통된 유전자 조절 패턴을 보임
-
공통 조절 경로: PRC2, TGFB, IGF, E2F, mTOR
-
일부 EWS-FLI1 표적 유전자도 EWS-WT1 억제 시 발현 변화 관찰 (>0.5 log₂FC)
6) ERG의 핵심 역할
-
EWS-WT1은 ETS 계열 전사인자 ERG를 유도함
-
ERG 억제 시
-
세포 증식 급격히 저하
-
caspase 활성화 → apoptosis 유도
→ ERG는 EWS-WT1 하위 전사 네트워크의 핵심 매개자
-
7) DNA 손상 복구 관련 특징
-
EWS-WT1 억제 후 Hallmark_DNA_repair 세트의 NES = -1.8, p = 0.0023
-
해당 세트에는 nucleotide excision repair 및 transcription-coupled repair 관련 유전자 포함
-
EWS-WT1은 TP53 억제와 동시에 DNA 복구 경로를 과활성화
→ 화학요법 내성의 분자적 근거 제시

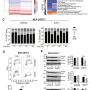
EWS-WT1 억제가 DSRCT 세포의 증식 정지를 유도한다
(a) 단백질 발현 억제의 특이성
-
연구진은 EWS-WT1만 선택적으로 억제하는 siRNA를 설계했다.
-
그림의 왼쪽에는 Western blot 결과가 나타나 있다.
-
EWS-WT1 단백질은 siRNA 처리 후 확실히 사라졌지만 정상형 EWSR1과 WT1 단백질은 그대로 유지되었다.
(b) 억제 시간에 따른 EWS-WT1 소실 과정
-
JN-DSRCT-1 세포에서 siRNA 처리 후 시간별 단백질 발현 변화를 관찰했다.
-
0시간에서는 EWS-WT1이 강하게 발현되지만, 48시간이 지나면 거의 완전히 사라진다.
-
이는 EWS-WT1 단백질이 빠르게 분해되고 세포가 그에 적응하지 못한다는 것을 보여준다.
(c), (d) 세포 증식 곡선 변화
-
두 개의 DSRCT 세포주(JN-DSRCT-1, BER)에 siRNA를 처리하고 세포 밀도(=세포 증식 정도)를 시간에 따라 측정했다.
-
결과
-
대조군(비표적 siRNA, 미처리 세포)은 일정하게 증식함
-
EWS-WT1 억제군은 48시간 이내에 세포 증식이 완전히 멈춤
-
-
세포 성장 곡선이 수평으로 꺾이면서 EWS-WT1이 사라지면 세포가 더 이상 나누어지지 못한다는 사실을 명확히 보여준다.
연구 결론
EWS-WT1 억제는 DSRCT 세포의 증식 정지와 apoptosis를 유도했으며, 전사체 분석 결과 EWS-WT1이 FGFR4, JAK3, IGF, mTOR, TGFB, ERG 등 세포 생존 신호를 활성화하고 TP53 경로를 억제하는 핵심 전사인자임이 밝혀졌다. 또한 EWS-WT1은 유잉 육종의 EWS-FLI1과 유사한 전사 네트워크를 공유해, 두 종양이 공통된 발암 기전을 가질 가능성이 제시됐다. 결국 DSRCT는 EWS-WT1 단백질에 생존을 절대적으로 의존하는 종양이며, 이를 직접 혹은 간접적으로 차단하는 표적치료 전략이 DSRCT 치료의 핵심 접근점이 될 수 있음을 보여줬다.


 SIK1과 CHEK1 동시 억제가 DSRCT 치료 표적으로 제시된다
SIK1과 CHEK1 동시 억제가 DSRCT 치료 표적으로 제시된다
 DSRCT 치료의 열쇠는 신호 경로 억제에 있다
DSRCT 치료의 열쇠는 신호 경로 억제에 있다




 손님
손님